職位推薦
- 珍格醫療-臨床銷售 15001-20000
- 地奧制藥-醫藥代表 6001-8000
- 普利德醫療-醫療設備銷售經理 面議
- 大唐-兼職招商經理 面議
- 景德中藥-直營經理 6001-8000
- 安邦醫藥-省區招商經理 8001-10000
- 恒瑞醫藥-醫藥信息溝通專員 6001-8000
- 黃河中藥-學術講師 8001-10000
發布日期:2025-03-18 瀏覽次數:141
3月11日,四川大學華西醫院生物治療全國重點實驗室陳俐娟/楊建洪團隊,陳強團隊及四川大學華西醫院護理創新研究中心黎勇團隊合作在PNAS雜志發表題為《Identification of a ligand-binding site on tubulin mediating the tubulin–RB3 interaction》的研究論文。該研究憑借前沿的科研技術與深入的探索,在細胞生物學領域取得了關鍵進展,首次成功揭示了位于微管蛋白(Tubulin)上的一個全新抑制劑結合位點。
這并非該團隊在 Tubulin 研究上的首次突破。在此之前,團隊已相繼發現 Pironetin 位點(發表于《自然通訊》,2016 年)和 Cevipabulin 位點(發表于《科學進展》,2021 年) 。此次 Tumabulin 位點的發現,是他們在該領域研究的又一重大飛躍。
該位點位于Tubulin-RB3-TTL復合物中α1-Tubulin、β1-Tubulin和RB3的界面區域,被命名為Tumabulin位點。Tumabulin類化合物作為“分子膠”,顯著增強了RB3與Tubulin二聚體之間的相互作用,從而提升了RB3的微管解聚活性。
Tumabulin位點的獨特之處在于其結合完全依賴于RB3的存在,且結合到該位點的小分子不會直接破壞微管的聚合,而是通過增強RB3與Tubulin的相互作用,顯著提升RB3固有的微管解聚活性。這一發現揭示了一種全新的Tubulin抑制機制,為針對RB3高表達癌癥的選擇性抗癌藥物設計開辟了新途徑,對Tubulin靶向藥物的開發具有重要科學意義。

αβ-Tubulin異二聚體是微管的核心組成單元,而微管在癌細胞的有絲分裂中扮演著至關重要的角色,因此成為癌癥化療的重要靶點。以紫杉醇和長春堿類藥物為代表的Tubulin抑制劑,在臨床上已展現出顯著的抗有絲分裂活性。根據作用機制的不同,Tubulin抑制劑可分為三大類:微管去穩定劑(Microtubule Destabilizing Agents, MDAs)、微管穩定劑(Microtubule Stabilizing Agents, MSAs)以及近年來發現的微管靶向降解劑(Microtubule-Targeting Degraders, MTDs)。結構生物學研究已成功解析了Tubulin二聚體上的八個主要結合位點(圖1),其中涵蓋了紫杉醇、秋水仙堿、長春堿、laulimalide、美登素、Pironetin、Cevipabulin和Todalam結合位點。其中,MSAs通常結合于紫杉醇和laulimalide位點,通過穩定微管結構抑制其解聚;而MDAs則主要靶向秋水仙堿、長春堿、美登素、Pironetin、Cevipabulin和Todalam位點,通過干擾微管聚合或促進其解聚發揮作用。MTDs則主要作用于Cevipabulin位點,同時也包括部分靶向秋水仙堿位點的降解劑,通過誘導Tubulin降解實現抗腫瘤效果。這些結合位點的發現為Tubulin抑制劑的開發提供了重要的結構基礎,同時也為針對不同機制的抗癌藥物設計開辟了新的方向。
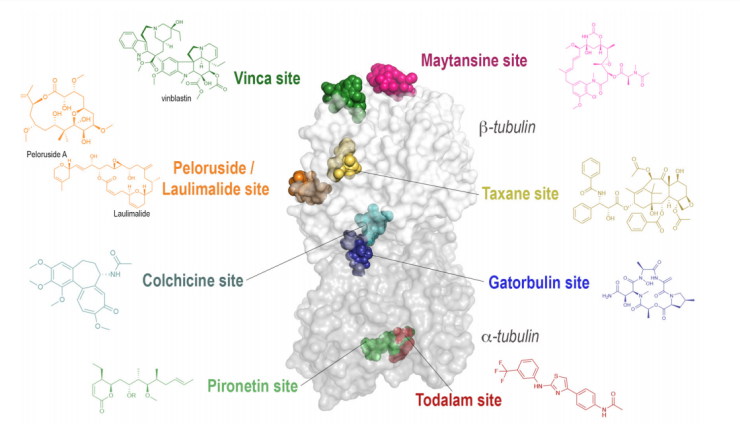
Tubulin二聚體上已報道的8個抑制劑結合位點
本研究通過解析Tumabulin類化合物Tumabulin-1(TM1)與Tubulin復合物的晶體結構,揭示了其獨特的結合模式。研究中使用了廣泛應用的Tubulin-RB3-Tubulin酪氨酸連接酶(TTL)復合物晶體。通過分析TM1結合的Tubulin-RB3-TTL復合物的晶體結構,研究人員觀察到TM1不僅與已知的秋水仙堿位點結合,還同時結合到一個先前未被識別的位點,科研團隊將這一新發現的位點命名為Tumabulin位點。該位點處于Tubulin-RB3-TTL復合物中α1-Tubulin、β1-Tubulin和RB3三者界面的交界區域。值得注意的是,兩個TM1分子在該位點內以堆疊的方式結合,完全填充了結合口袋,并形成了強烈的分子間相互作用。
然而,由于TM1同時與秋水仙堿位點和Tumabulin位點結合,這兩個位點之間的潛在干擾可能影響對TM1在Tumabulin位點的特定生化功能的準確解析。為克服這一限制,科研團隊精心設計并合成了化合物TM2。TM2對Tubulin-RB3復合物的Tumabulin位點具有高度選擇性,且不與秋水仙堿位點發生相互作用。
功能實驗表明,TM2顯著增強了RB3與Tubulin的結合。進一步研究發現,TM2本身對Tubulin無直接解聚作用,但顯著增強了RB3對Tubulin聚合的抑制作用,提示TM2通過結合Tumabulin位點增強了RB3的Tubulin解聚活性。
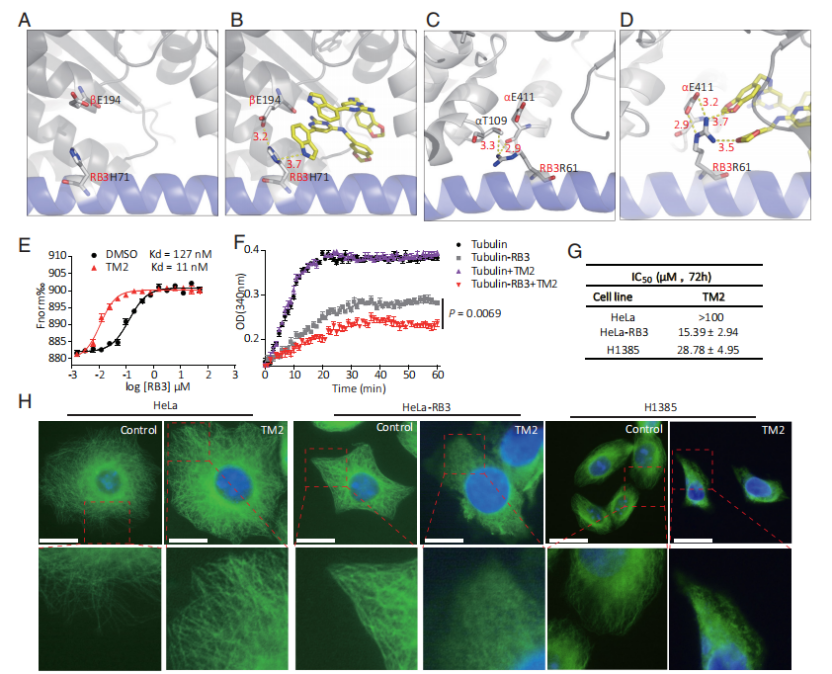
TM2抑制微管的作用機制
該研究成功確定了Tubulin上一個新的配體結合位點,該位點在介導Tubulin與RB3之間的相互作用中表現出獨特的功能,為下一代抗癌Tubulin抑制劑的發現和研究奠定了重要基礎。
華西醫院楊建洪副研究員、陳強研究員及黎勇副研究員為該論文的共同通訊作者。黎勇副研究員、張楚楓博士后、唐冬梅博士后、王濤助理研究員及閆偉助理研究員為共同第一作者。四川大學華西醫院為該成果唯一完成單位。
300多萬優質簡歷
17年行業積淀
2萬多家合作名企業

微信掃一掃 使用小程序

