職位推薦
- 珍格醫(yī)療-臨床銷售 15001-20000
- 地奧制藥-醫(yī)藥代表 6001-8000
- 普利德醫(yī)療-醫(yī)療設(shè)備銷售經(jīng)理 面議
- 大唐-兼職招商經(jīng)理 面議
- 景德中藥-直營經(jīng)理 6001-8000
- 安邦醫(yī)藥-省區(qū)招商經(jīng)理 8001-10000
- 恒瑞醫(yī)藥-醫(yī)藥信息溝通專員 6001-8000
- 黃河中藥-學(xué)術(shù)講師 8001-10000
發(fā)布日期:2025-02-21 瀏覽次數(shù):21

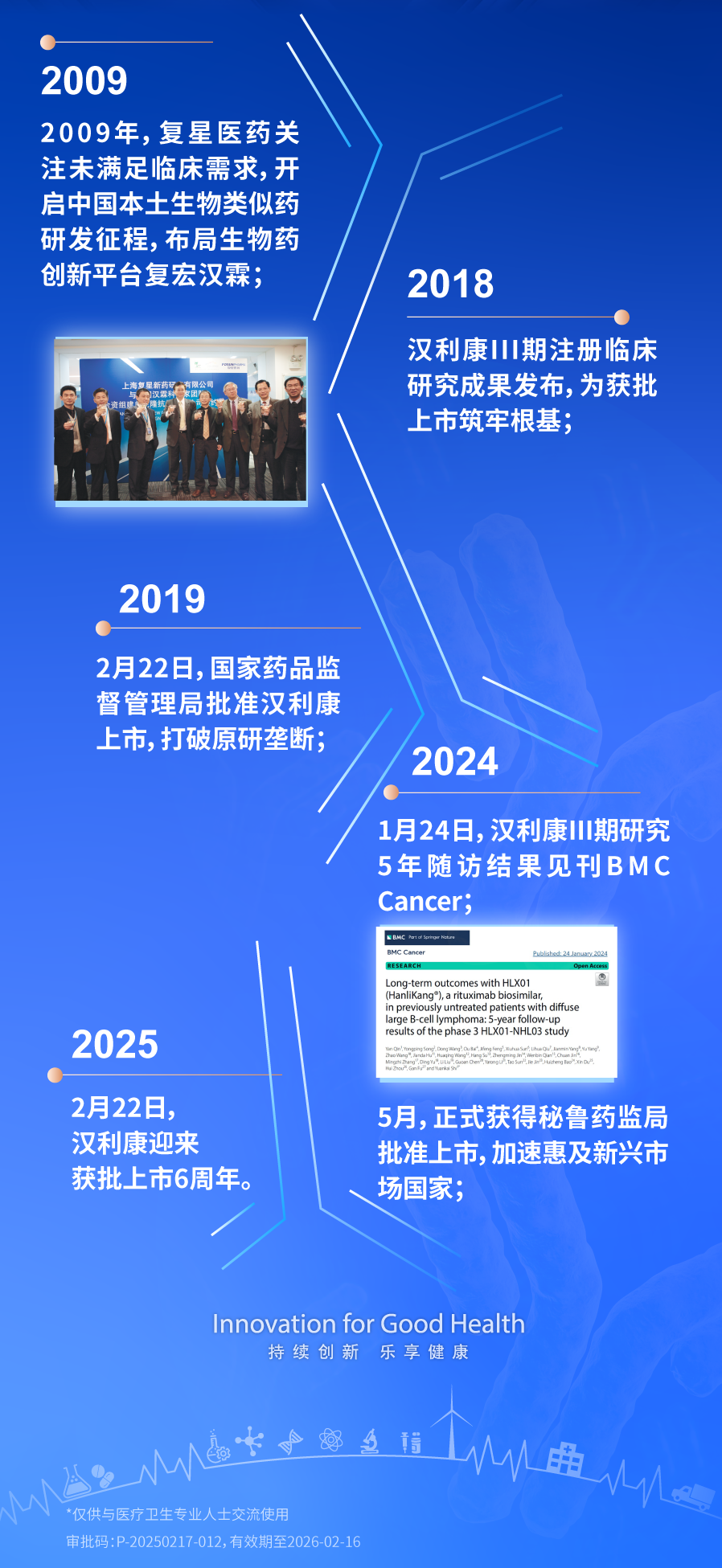
10年研發(fā),6年愈證,2025年2月22日,中國首個自主研發(fā)的CD20單抗生物類似藥漢利康®迎來上市6周年。自獲批至今,漢利康®以卓越的臨床價值與可及性,不僅填補了國內(nèi)生物類似藥領(lǐng)域空白,更推動淋巴瘤診療邁向規(guī)范化、普惠化,并于2024年首次迎來海外獲批,加速惠及全球患者。






01
打破壟斷,開啟中國生物類似藥新紀元
利妥昔單抗作為首個用于淋巴瘤治療的單克隆抗體,開創(chuàng)了免疫化療的新紀元。在彌漫大B細胞淋巴瘤(DLBCL)和濾泡淋巴瘤(FL)一線治療中,利妥昔單抗是核心藥物,顯著提高了療效和生存率。然而,其高昂價格限制了其廣泛應(yīng)用。復(fù)星醫(yī)藥自主研發(fā)的中國首個自研CD20單抗?jié)h利康®的誕生,標志著中國生物類似藥研發(fā)實現(xiàn)“零的突破”。其研發(fā)歷時十年,通過嚴格的III期臨床研究及5年隨訪數(shù)據(jù)驗證,證實其與原研藥在療效、安全性上高度一致,且價格僅為原研藥的1/3。這一突破不僅打破了外資藥企的長期壟斷,更推動原研藥價格大幅下調(diào)并加速納入醫(yī)保,極大提升了藥物可及性。?
漢利康®的上市,為中國生物類似藥研發(fā)樹立了高質(zhì)量標桿。其遵循國際標準的研發(fā)路徑,促進了行業(yè)技術(shù)標準化與監(jiān)管體系完善,帶動國內(nèi)生物藥領(lǐng)域進入快速發(fā)展期。截至目前,以漢利康®為代表的利妥昔單抗已推動大中城市三甲醫(yī)院淋巴瘤患者5年無病生存率從20%提升至50%,成為我國生物醫(yī)藥自主創(chuàng)新的典范。
02
循證為基:臨床研究力證長期療效與安全性
漢利康®的核心競爭力源于扎實的循證醫(yī)學(xué)支持。III期HLX01-NHL03研究納入407例初治彌漫大B細胞淋巴瘤(DLBCL)患者,經(jīng)過65個月長期隨訪顯示:漢利康®聯(lián)合化療(H-CHOP)組與原研藥聯(lián)合化療(R-CHOP)組的5年總生存率(OS)分別為81%和75.4%,無進展生存率(PFS)分別為77.7%和73%,兩組無統(tǒng)計學(xué)差異,且安全性表現(xiàn)一致。這一成果被國際權(quán)威期刊《BMC Cancer》收錄,為漢利康®的等效性提供了強有力證據(jù)。
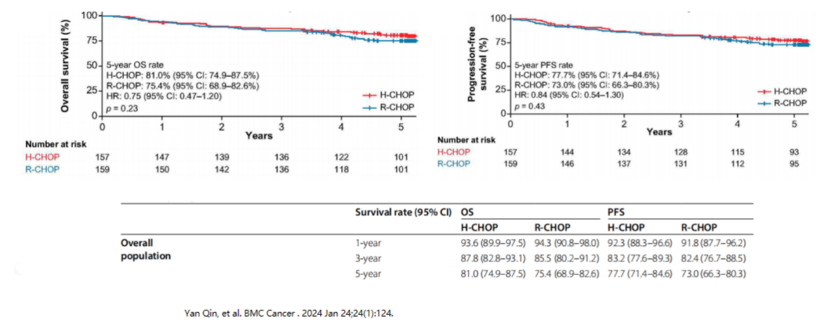
總體人群5年OS:H-CHOP組 81.0%,R-CHOP組 75.4%,無統(tǒng)計學(xué)差異
在惰性淋巴瘤領(lǐng)域,漢利康®聯(lián)合長效干擾素的RIPPLE研究同樣成果顯著。中位隨訪34.2個月的數(shù)據(jù)顯示,初治晚期濾泡淋巴瘤(FL)患者的完全緩解率達50.9%,3年P(guān)FS和OS分別為70.4%和92.5%,為早期干預(yù)提供了新思路。此外,漢利康®在真實世界中的應(yīng)用進一步驗證其療效:覆蓋全國超千家醫(yī)療機構(gòu)的臨床實踐表明,其毒副反應(yīng)可控、使用便捷,已成為醫(yī)生和患者的優(yōu)選方案。?
03
普惠患者:可及性驅(qū)動診療格局變革
漢利康®的上市,直接推動了淋巴瘤治療的“普惠化”。原研藥價格曾導(dǎo)致85%的患者因經(jīng)濟負擔(dān)中斷治療,而漢利康®通過醫(yī)保談判大幅降低用藥成本,使更多患者能夠完成規(guī)范治療周期。據(jù)統(tǒng)計,以漢利康®為代表的利妥昔單抗上市后,我國DLBCL患者接受免疫化療的比例提升40%,基層醫(yī)院淋巴瘤診療能力同步增強。?
其臨床價值還體現(xiàn)在治療策略優(yōu)化上。對于老年體弱或低腫瘤負荷的FL患者,漢利康®單藥治療被證實安全有效,成為國內(nèi)外指南推薦的一線方案;在聯(lián)合治療領(lǐng)域,其與化療、靶向藥物的協(xié)同作用,為個體化治療提供了更多可能。行業(yè)專家指出,漢利康®的示范效應(yīng)將加速更多優(yōu)質(zhì)生物類似藥上市,形成良性競爭生態(tài)。與此同時,其長期隨訪數(shù)據(jù)的積累,為全球生物類似藥研發(fā)提供了“中國經(jīng)驗”。2024年5月,漢利康®正式獲得秘魯藥監(jiān)局批準上市,商品名為AUDEXA®。作為中國首個生物類似藥的漢利康®首次迎來海外獲批,將加速惠及新興市場國家。
6年來,漢利康®以“自研+普惠”雙輪驅(qū)動,改寫了中國淋巴瘤治療史。未來,隨著更多臨床研究的推進與適應(yīng)癥拓展,漢利康®有望進一步鞏固其在血液腫瘤領(lǐng)域的核心地位,并助力中國在全球生物醫(yī)藥賽道占據(jù)更重要的位置。?
正如行業(yè)所期許:“漢利康®的歷程證明,自主創(chuàng)新與患者需求深度融合,方能催生改變時代的良藥。”在下一個6年,復(fù)星醫(yī)藥人將繼續(xù)以創(chuàng)新驅(qū)動為核心,讓更多“可及可愈”的創(chuàng)新成果惠及全球。

300多萬優(yōu)質(zhì)簡歷
17年行業(yè)積淀
2萬多家合作名企業(yè)

微信掃一掃 使用小程序
