職位推薦
- 珍格醫療-臨床銷售 15001-20000
- 地奧制藥-醫藥代表 6001-8000
- 普利德醫療-醫療設備銷售經理 面議
- 大唐-兼職招商經理 面議
- 景德中藥-直營經理 6001-8000
- 安邦醫藥-省區招商經理 8001-10000
- 恒瑞醫藥-醫藥信息溝通專員 6001-8000
- 黃河中藥-學術講師 8001-10000
發布日期:2024-09-10 瀏覽次數:72

近日,復星醫藥自主研發的治療ALK 陽性非小細胞肺癌(NSCLC)的創新藥復瑞替尼(Foritinib,SAF-189s)III期研究期中分析結果于2024年世界肺癌大會(WCLC)期間重磅發布。
由上海同濟大學附屬東方醫院周彩存教授牽頭開展的復瑞替尼III期REMARK研究榮幸入選此次大會的最新突破性摘要(LBA,編號:OA09.03),并由主要研究者上海同濟大學附屬東方醫院熊安穩教授口頭匯報了其治療ALK 陽性非小細胞肺癌(NSCLC)患者的主要期中分析結果1,再次表明復瑞替尼是極具前景的治療非小細胞肺癌的創新藥物。
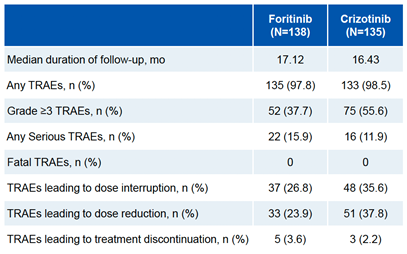
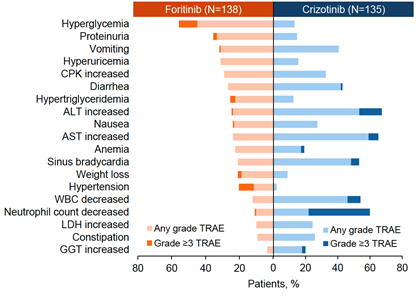
肺癌位居全球及中國癌癥的發生率和死亡率首位2-3。2022年,中國肺癌新發患者高達約106萬,肺癌死亡人數亦超過73萬4。肺癌患者中約80%-85%為非小細胞肺癌,而我國NSCLC患者中約5.6%呈現間變性淋巴瘤激酶(ALK)基因突變4-5。目前多項研究表明了二代或三代ALK抑制劑的療效,ALK陽性患者治療進入“慢病化”管理模式。但耐藥、疾病復發和中樞神經系統進展、以及各種安全性等問題仍然存在。因此,臨床上亟需一款兼顧安全性和療效的可及性藥物。復瑞替尼(Foritinib)是一種在研的高效、具有CNS高滲透性的ALK/ROS1抑制劑,且具有非常好的安全性6。
研究方法REMARK研究是一項開放標簽、隨機、III期臨床研究,納入了既往未經治療的ALK陽性晚期NSCLC患者。患者根據基線ECOG評分(0/1 vs 2)和是否發生CNS轉移進行分層分析,并按1:1比例隨機分為接受復瑞替尼治療(160 mg,每日一次)或克唑替尼治療(250 mg,每日兩次)。研究主要終點為由獨立評審委員會(IRC)評估的無進展生存期(PFS),次要終點包括由研究者(INV)評估的PFS和客觀應答率(ORR);由IRC和INV評估的應答時間(TTR)和應答持續時間(DOR);由IRC評估的顱內 ORR(C-ORR)、顱內TTR(C-TTR)、顱內DOR(C-DOR)和所有受試者至CNS進展時間(CNS-TTP);以及總生存期(OS)和安全性(圖1)。
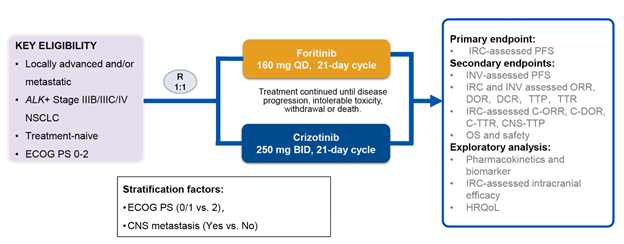
圖1. 研究設計
研究結果從2020年12月至2022年3月,該研究共招募275例患者,其中139例接受復瑞替尼治療,136接受克唑替尼治療(圖2)。截至2024年3月,中位隨訪時間為16.7個月。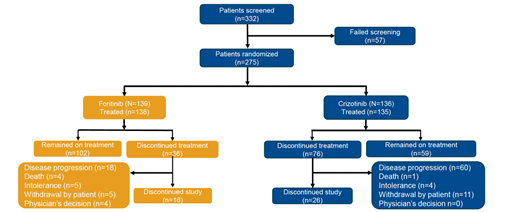
圖2. 患者入組情況
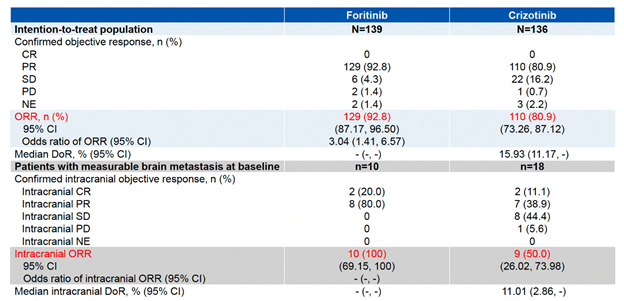
研究發現,復瑞替尼治療組的PFS相較于克唑替尼治療組具有顯著改善,克唑替尼治療組的中位PFS為13.93個月,而復瑞替尼治療組尚未達到(HR 0.23, 95% CI 0.14-0.38, 圖3)。
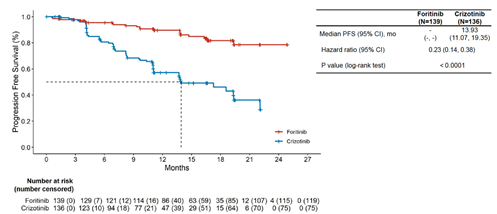
圖3. 兩組患者治療后IRC-PFS
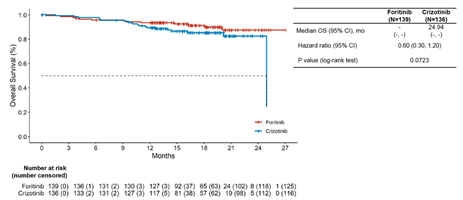
此外,相比于克唑替尼,復瑞替尼顯著降低CNS進展風險。克唑替尼治療組中位CNS-TTP為19.32個月,而復瑞替尼組尚未達到(HR 0.04, 95% CI 0.01-0.14, 圖4)。另外,復瑞替尼有改善OS的趨勢(HR 0.60, 95% CI 0.30-1.20, 圖5)。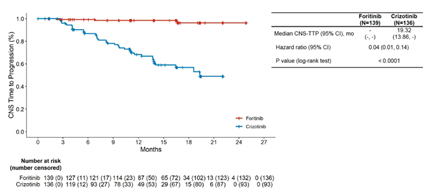

300多萬優質簡歷
17年行業積淀
2萬多家合作名企業

微信掃一掃 使用小程序

