職位推薦
- 珍格醫(yī)療-臨床銷售 15001-20000
- 地奧制藥-醫(yī)藥代表 6001-8000
- 普利德醫(yī)療-醫(yī)療設(shè)備銷售經(jīng)理 面議
- 大唐-兼職招商經(jīng)理 面議
- 景德中藥-直營經(jīng)理 6001-8000
- 安邦醫(yī)藥-省區(qū)招商經(jīng)理 8001-10000
- 恒瑞醫(yī)藥-醫(yī)藥信息溝通專員 6001-8000
- 黃河中藥-學(xué)術(shù)講師 8001-10000

發(fā)布日期:2024-06-03 瀏覽次數(shù):148
正在進(jìn)行的2024年美國臨床腫瘤學(xué)會(ASCO)年會上,恒瑞醫(yī)藥創(chuàng)新藥PD-1抑制劑卡瑞利珠單抗(艾瑞卡?)聯(lián)合小分子靶向藥物阿帕替尼(艾坦?)(“雙艾”組合)治療不可切除肝細(xì)胞癌(uHCC)的全球多中心III期臨床研究(CARES-310研究)最終分析數(shù)據(jù)由漢諾威醫(yī)學(xué)院的Arndt Vogel教授重磅公布。研究結(jié)果顯示1,經(jīng)隨后16個月的進(jìn)一步隨訪,“雙艾”聯(lián)合組的中位總生存期(OS)達(dá)到23.8個月,患者生存獲益再創(chuàng)新高。所有獲批肝細(xì)胞癌一線治療適應(yīng)癥的方案中,“雙艾”方案是迄今為止獲得最長中位OS研究數(shù)據(jù)的治療方案2-7。
基于期中研究數(shù)據(jù)
CARES-310研究已登頂《柳葉刀》主刊
CARES-310研究是一項(xiàng)前瞻性、隨機(jī)、平行、對照開放標(biāo)簽的國際多中心關(guān)鍵性III期臨床研究,由中國藥科大學(xué)附屬南京天印山醫(yī)院秦叔逵教授牽頭開展,全球13個國家/地區(qū)的95家中心共同參與,評估了“雙艾”組合對比索拉非尼治療既往未接受過系統(tǒng)治療的不可切除和轉(zhuǎn)移性HCC患者的有效性和安全性。
2022年歐洲腫瘤內(nèi)科學(xué)會(ESMO)大會初次報(bào)告了CARES-310研究的療效數(shù)據(jù)8,期中分析數(shù)據(jù)顯示,截至2022年2月8日,“雙艾”聯(lián)合組的中位無進(jìn)展生存期(mPFS)達(dá)到5.6個月,而對照組僅為3.7個月(HR=0.52);mOS長達(dá)22.1個月,相較對照組(15.2個月)顯著獲益(HR=0.62,95%CI:0.49-0.80,p<0.0001);1年OS率達(dá)76.5%,對照組僅60.8%,且安全性良好9。基于該研究結(jié)果,“雙艾”組合于2023年初獲得國家藥監(jiān)局(NMPA)批準(zhǔn)用于不可切除或轉(zhuǎn)移性肝細(xì)胞癌患者的一線治療。2023年7月,該研究數(shù)據(jù)重磅發(fā)表于《柳葉刀》主刊(The Lancet,IF:168.9)。
中位總生存期達(dá)23.8個月
“雙艾”助力晚期肝癌患者更長生存
本次ASCO大會上,CARES-310研究報(bào)告了繼續(xù)隨訪16個月后的最終分析(FA)的更新數(shù)據(jù)。543例既往未接受過全身治療的uHCC患者按1:1的比例隨機(jī)接受卡瑞利珠單抗+阿帕替尼(n=272)或索拉非尼(n=271)治療。截至2023年6月14日,進(jìn)行了方案規(guī)定的FA。
“雙艾”聯(lián)合組的中位隨訪時間為22.1個月,對照組為14.9個月。研究治療結(jié)束后,“雙艾”聯(lián)合組36%和對照組42%的患者接受了后續(xù)靶向治療;“雙艾”聯(lián)合組17%和對照組36%的患者接受了后續(xù)免疫治療。療效結(jié)果顯示1,“雙艾”聯(lián)合組的mOS顯著延長,達(dá)到23.8個月(對照組僅為15.2個月;HR=0.64,單側(cè)p<0.0001),逼近2年,患者生存獲益再創(chuàng)新高,“雙艾”方案開啟晚期HCC一線治療新篇章。
“雙艾”聯(lián)合組更新后的mOS數(shù)據(jù)
此外,在地理區(qū)域、人種和病因各亞組中,“雙艾”聯(lián)合組的OS獲益基本一致。

亞組mOS森林圖
另外,“雙艾”聯(lián)合組和對照組的2年OS率分別為49.0%和36.2%,3年OS率分別為37.7%和24.8%。CARES-310研究也是首個晚期HCC靶免聯(lián)合治療領(lǐng)域報(bào)告3年OS率的III期研究,且近四成患者存活超過3年。
“雙艾”方案有望使更多晚期HCC患者實(shí)現(xiàn)長期生存,這也是恒瑞醫(yī)藥助力“健康中國2030”總體癌癥5年生存率目標(biāo)實(shí)現(xiàn)作出的又一積極探索。
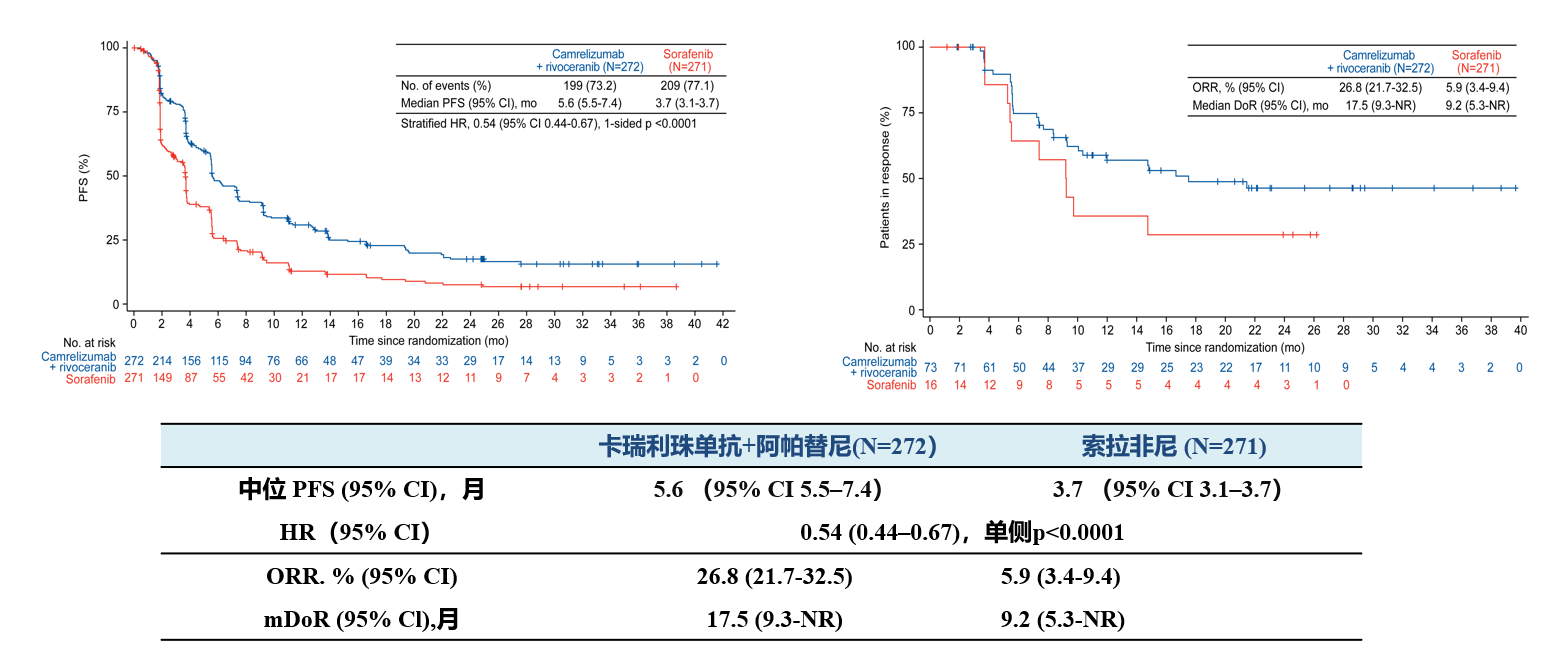
雙艾”聯(lián)合組的PFS、客觀緩解率(ORR)和緩解持續(xù)時間(DoR)也在長時間隨訪中保持穩(wěn)定。且安全性數(shù)據(jù)與期中OS分析一致,未觀察到新的安全性信號。

“雙艾”聯(lián)合組和對照組的PFS、ORR、DoR數(shù)據(jù)更新
綜上所述,在方案規(guī)定的FA中,相較對照組,“雙艾”方案持續(xù)顯示出有臨床意義的生存期改善,且安全性可控。本次擴(kuò)展隨訪進(jìn)一步支持了“雙艾”方案作為uHCC的新一線治療選擇。
肝癌臨床治療需求亟待滿足
靶免聯(lián)合治療方案為肝癌患者提供新選擇
據(jù)2022年全球癌癥數(shù)據(jù)統(tǒng)計(jì),原發(fā)性肝癌居世界常見惡性腫瘤的第6位和惡性腫瘤死亡原因的第3位,在中國,原發(fā)性肝癌新發(fā)病例數(shù)達(dá)367657例,約占全球新發(fā)病例數(shù)的42.5%,其中85%-90%為HCC,患者疾病負(fù)擔(dān)沉重10。而且肝癌起病隱匿,多數(shù)患者確診時已處于晚期,失去根治性手術(shù)治療機(jī)會,系統(tǒng)治療發(fā)揮著更為重要的作用。
近年來,免疫治療的快速發(fā)展改寫了晚期肝癌的治療格局,尤其是靶免聯(lián)合治療方案已成為晚期HCC的重要一線治療模式。卡瑞利珠單抗是恒瑞醫(yī)藥自主研發(fā)的一款人源化PD-1單克隆抗體,于2019年5月獲國家藥品監(jiān)督管理局(NMPA)批準(zhǔn)上市,目前已在中國獲批9個適應(yīng)癥,涵蓋肺癌、肝癌、食管癌、鼻咽癌以及淋巴瘤五大瘤種,為獲批適應(yīng)癥和覆蓋瘤種數(shù)量領(lǐng)先的國產(chǎn)PD-1產(chǎn)品。阿帕替尼是恒瑞醫(yī)藥開發(fā)的一款針對血管內(nèi)皮生長因子受體(VEGFR)的小分子酪氨酸激酶抑制劑,于2014年10月獲國家藥品監(jiān)督管理局(NMPA)批準(zhǔn)上市。目前已在胃癌和肝癌領(lǐng)域獲批三個適應(yīng)癥。
CARES-310研究從登頂《柳葉刀》主刊,到如今再次亮相國際大會,充分體現(xiàn)了國際學(xué)術(shù)界對恒瑞創(chuàng)新能力和“雙艾”組合的認(rèn)可。期待“雙艾”組合在未來造福更多晚期肝癌患者。
《“健康中國2030”規(guī)劃綱要》提出“到2030年,要實(shí)現(xiàn)總體癌癥5年生存率提高15%”的戰(zhàn)略目標(biāo)。抗腫瘤藥物是癌癥患者控制和治療疾病的重要希望。作為創(chuàng)新型國際化制藥企業(yè),恒瑞醫(yī)藥長期堅(jiān)持“科技為本,為人類創(chuàng)造健康生活”的使命,針對腫瘤等嚴(yán)重威脅人類生命健康的疾病開展科研攻關(guān),已上市的16款創(chuàng)新藥中抗腫瘤創(chuàng)新藥占比過半。未來,恒瑞醫(yī)藥將繼續(xù)堅(jiān)持“以患者為中心”的理念,重創(chuàng)新,強(qiáng)研發(fā),力爭研制出更多的新藥、好藥,服務(wù)“健康中國”,惠及全球患者。
參考文獻(xiàn)
1.Camrelizumab plus rivoceranib vs sorafenib as first-line therapy for unresectable hepatocellular carcinoma (uHCC): Final overall survival analysis of the phase 3 CARES-310 study. ASCO 2024:Poster abstract 4110.
2.Yau T, Park JW, Finn RS, et al. Nivolumab versus sorafenib in advanced hepatocellular carcinoma (CheckMate 459): a randomised,multicentre, open-label, phase 3 trial. Lancet Oncol 2022; 23: 77–90.
3.Finn RS, Qin S, Ikeda M, et al. Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. N Engl J Med 2020;382: 1894–905.
4.Kelley RK, Rimassa L, Cheng A-L, et al. Cabozantinib plus atezolizumab versus sorafenib for advanced hepatocellular carcinoma (COSMIC-312): a multicentre, open-label, randomised,phase 3 trial. Lancet Oncol 2022; 23: 995–1008.
5.Llovet JM, Kudo M, Merle P, et al. Lenvatinib plus pembrolizumab versus lenvatinib plus placebo for advanced hepatocellular carcinoma (LEAP-002): a randomised, double-blind, phase 3 trial Lancet Oncol. 2023 Dec;24(12):1399-1410.
6.Ren Z, Xu J, Bai Y, et al. Sintilimab plus a bevacizumab biosimilar(IBI305) versus sorafenib in unresectable hepatocellular carcinoma(ORIENT-32): a randomised, open-label, phase 2–3 study. Lancet Oncol. 2021 Jul;22(7):977-990.
7.Abou-Alfa GK, Lau G, Kudo M, et al. Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. NEJM Evid.2022 Aug; 1(8): EVIDoa2100070.
8.Shukui Qin, et al. Camrelizumb(C) plus rivoceranib (R) vs. sorafenib (S) as first-line therapy for unresectable hepatocellular carcinoma (uHCC): a randomized, phase III trial. ESMO 2022 LBA35.
9.Shukui Qin, et al. Camrelizumab plus rivoceranib versus sorafenib as first-line therapy for unresectable hepatocellular carcinoma (CARES-310): a randomised, open-label, international phase 3 study.Lancet. 2023, July 24.
10.Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024 May-Jun;74(3):229-263.
聲明:
1.本新聞旨在分享學(xué)術(shù)前沿動態(tài),僅供醫(yī)療衛(wèi)生專業(yè)人士基于學(xué)術(shù)目的參閱,非廣告用途。
2.恒瑞醫(yī)藥不對任何藥品和/或適應(yīng)癥作推薦。
300多萬優(yōu)質(zhì)簡歷
17年行業(yè)積淀
2萬多家合作名企業(yè)

微信掃一掃 使用小程序
