職位推薦
- 珍格醫療-臨床銷售 15001-20000
- 地奧制藥-醫藥代表 6001-8000
- 普利德醫療-醫療設備銷售經理 面議
- 大唐-兼職招商經理 面議
- 景德中藥-直營經理 6001-8000
- 安邦醫藥-省區招商經理 8001-10000
- 恒瑞醫藥-醫藥信息溝通專員 6001-8000
- 黃河中藥-學術講師 8001-10000
發布日期:2019-09-12 瀏覽次數:322
9月12日,恒瑞醫藥卡瑞利珠單抗單藥二線治療晚期食管鱗癌、卡瑞利珠單抗聯合培美曲塞加卡鉑一線治療晚期或轉移性非鱗癌非小細胞肺癌的上市申請獲得國家藥品監督管理局受理。
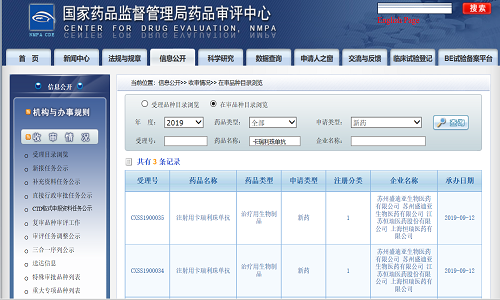
恒瑞醫藥卡瑞利珠單抗聯合培美曲塞加卡鉑與培美曲塞加卡鉑一線治療晚期或轉移性非鱗癌非小細胞肺癌患者的隨機對照多中心III期臨床研究由同濟大學醫學院附屬上海市肺科醫院周彩存教授擔任主要研究者,牽頭52家中心負責完成。近日,該項研究全體受試人群的主要終點-IRC評估的無進展生存期(PFS)達到方案預設的期中分析優效判定標準,且安全性可接受。研究結果表明,對于一線的晚期或轉移性非鱗癌非小細胞肺癌患者,接受卡瑞利珠單抗聯合培美曲塞加卡鉑治療對比培美曲塞加卡鉑一線治療,可顯著延長患者的無進展生存期。卡瑞利珠單抗單藥二線治療晚期食管鱗癌的隨機、開放、化療藥對照、多中心III期臨床研究已于2019年7月達到主要研究終點。
注射用卡瑞利珠單抗是恒瑞醫藥自主研發并具有知識產權的人源化PD-1單克隆抗體,已于2019年5月獲批上市。目前,除已獲批的復發/難治性霍奇金淋巴瘤適應癥外,已有肝細胞癌、晚期食管鱗癌、晚期或轉移性非鱗癌非小細胞肺癌等 3 個新適應癥申報上市,其中,肝細胞癌適應癥基于II期臨床試驗獲得的療效和安全性數據被國家藥品監督管理局納入擬優先審評。與此同時,恒瑞醫藥正在中國開展評估卡瑞利珠單抗單藥或聯合不同的治療手段的32項研究,其中,卡瑞利珠單抗聯合阿帕替尼一線治療晚期肝細胞癌III期臨床研究正在中國、美國等地同步開展。
300多萬優質簡歷
17年行業積淀
2萬多家合作名企業

微信掃一掃 使用小程序

